แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์การเปลี่ยนสถานะของสารต้องมีการให้ความร้อนแก่สาร เพื่อให้อนุภาคของสารมีพลังงานจลน์สูงพอที่จะหลุดออกจากกัน แสดงว่าสารแต่ละสถานะมีแรงยึดเหนี่ยวระหว่างโมเลกุล ซึ่งเรียงลำดับจากมากไปน้อยดังนี้ ของแข็ง > ของเหลว > ก๊าซการเปลี่ยนสถานะของสารโคเวเลนต์ มีการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุลเท่านั้น ไม่มีการทำลายพันธะเคมี ดังนั้นสารที่มีจุดเดือดจุดหลอมเหลวสูง แสดงว่าแรงยึดเหนี่ยวระหว่างโมเลกุลสูงประเภทของแรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์ มีดังนี้
- แรงลอนดอน ( london foece ) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล ยึดเหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตามมวลโมเลกุลของสาร
- แรงดึงดูดระหว่างขั้ว (dipole – dipole force ) เป็นแรงดึงดูดทางไฟฟ้าอันเนื่องมาจากแรงกระทำระหว่างขั้วบวกกับขั้วลบของโมเลกุลที่มีขั้ว
สารโคเวเลนต์ที่มีขั้ว มีแรงยึดเหนี่ยวระหว่างโมเลกุล 2 ชนิดรวมอยู่ด้วยกันคือ แรงลอนดอนกับแรงดึงดูดระหว่างขั้ว และเรียกแรง 2 แรงรวมกันว่าแรงแวนเดอร์วาลส์3. พันธะไฮโดรเจน(hydrogen bond , H – bond ) คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจน
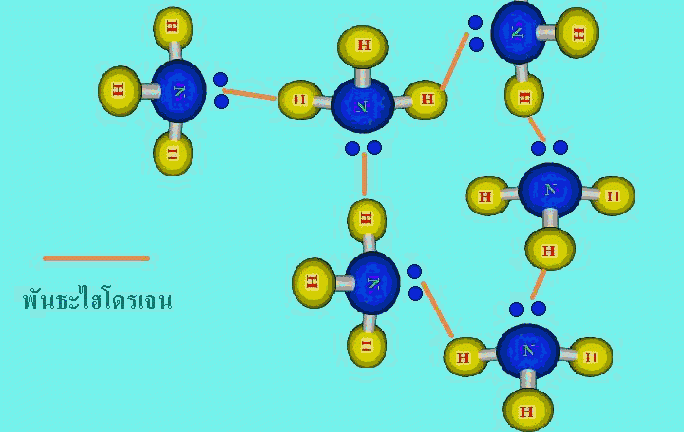
แรงยึดเหนี่ยวระหว่างโมเลกุลทั้ง 3 ชนิดนี้ พันธะไฮโดรเจนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงที่สุด ขณะที่แรงลอนดอนจัดเป็นแรงยึดเหนี่ยวที่แข็งแรงน้อยที่สุด และทั้ง 3 แรงนี้แข็งแรงน้อยกว่าพันธะโคเวเลนต์ พันธะไออนิก และพันธะโลหะมาก
สมบัติของสารโคเวเลนต์
1. มีจุดเดือดจุดและหลอมเหลวต่ำ เพราะจะทำให้เดือดหรือหลอมเหลวต้องใช้พฃังงานไปในการทำลายแรงยึดเหนี่ยวระหว่างโมเลกุล ( ไม่ได้ทำลายพันธะโคเวเลนต์ ยกเว้นโครงผลึกร่างตาข่าย ) อาจจะแบ่งสารโคเวนต์ตามจุดเดือด จุดหลอมเหลว จะได้ 4 พวกดังนี้
1.1สารโคเวเลนต์ไม่มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวต่ำกว่าพวกอื่นๆ เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงลอนดอนอย่างเดียวเท่านั้น1.2 สารโคเวเลนต์มีขั้ว พวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าพวกไม่มีขั้ว เพราะยึดเหนี่ยวโมเลกุลด้วยแรง 2 แรง คือแรงลอนดอลและแรงดึงดูดระหว่างขั้ว1.3 สารโคเวเลนต์ที่สามารถสร้างพันธะไฮโดรเจนได้ เช่น HF , NH3, H2Oพวกนี้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโคเวเลนต์ที่มีขั้ว เพราะโมเลกุลยึดเหนี่ยวกันด้วยแรงแวนเดอร์วาลส์และพันธะไฮโดรเจน1.4 พวกที่มีโครงสร้างเป็นโครงผลึกร่างตาข่าย เช่น เพชร แกรไฟต์ คาร์บอรันดัม ซิลิกอนไดออกไซด์ พวกนี้มีจุดเดือดจุดหลอมเหลวสูงมาก ซึ่งโดยทั่วไปสารโคเวเลนต์มีจุดเดือดจุดหลอมเหลวต่ำ ที่เป็นเช่นนี้เพราะการจัดเรียงอะตอมภายในผลึก
2. สารโคเวเลนต์จะไม่นำไฟฟ้าไม่ว่าจะอยู่ในสถานะใด ( ยกเว้น แกรไฟต์ ) เนื่องจากไม่มีอิเล็กตรอนอิสระ และเมื่อหลอมเหลวไม่แตกตัวเป็นอิออน3. โมเลกุลที่มีขั้วสามารถละลายในตัวทำละลายที่โมเลกุลมีขั้วได้ และโมเลกุลที่ไม่มีขั้วสามารถละลายในตัวทำละลายที่ไม่มีขั้วได้(มีขั้วกับมีขั้ว , ไม่มีขั้วกับไม่มีขั้ว= ละลายกันได้ แต่มีขั้วกับไม่มีขั้วไม่ละลายกัน
ที่มา : คลิกที่นี่
หน้าต่อไป : คลิกที่นี่


ไม่มีความคิดเห็น:
แสดงความคิดเห็น