รูปร่างโมเลกุลโคเวเลนต์
รูปร่างโมเลกุลโคเวเลนต์ขึ้นอยู่กับ ทิศทางของพันธะโคเวเลนต์ , ความยาวพันธะ , และมุมระหว่างพันธะโคเวเลนต์รอบอะตอมกลางทิศทางของพันธะขึ้นอยู่กับ- แรงผลักระหว่างพันธะรอบอะตอมกลาง เพื่อให้ห่างกันมากที่สุด-แรงผลักของอิเล็กตรอนคู่อิสระของอะตอมกลางที่มีต่อพันธะรอบอะตอมกลางแรงนี้มีค่ามากกว่าแรงที่พันธะผลักกันเองรูปร่างโมเลกุลโคเวเลนต์ที่ควรรู้จัก1.รูปร่างเส้นตรง(Limear) โมเลกุล BeCl2และสูตรโครงสร้างดังนี้
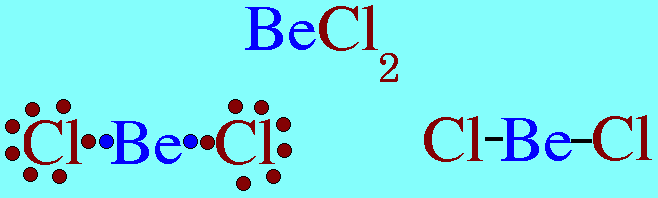
อะตอมกลาง Be ในโมเลกุล BeCl2มีอิเล็กตรอนทั้งหมด 2 ตัว และทั้ง 2 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ ซึ่งจะผลักกันให้ห่างกันให้มากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
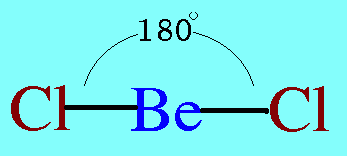 โมเลกุล CO2มีสูตรโครงสร้างดังนี้
โมเลกุล CO2มีสูตรโครงสร้างดังนี้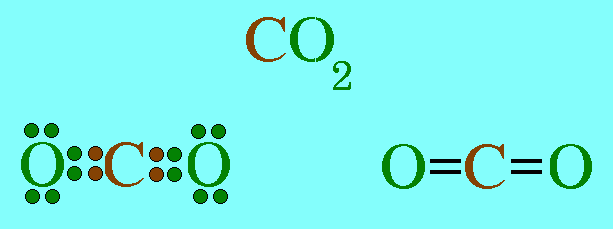
อะตอมกลาง C ในโมเลกุล CO2มีเวเลนต์อิเล็กตรอน 4 ตัว และทั้ง 4 ตัวเป็นอิเล็กตรอนคู่ร่วมพันธะ(เกิดพันธะคู่กับอะตอม O 2 พันธะ) ทำให้เกิดแรงผลักกันระหว่างพันธะให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปเส้นตรง มีมุมระหว่างพันธะ 180๐ดังรูป
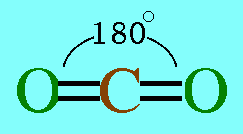
สรุปโมเลกุลของสารโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 2 พันธะ จะเป็นพันธะชนิดใดก็ได้ และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็นเส้นตรง2. รูปร่างสามเหลี่ยมแบนราบ(Trigonal planar)โมเลกุล BCl3มีสูตรโครงสร้าง ดังนี้
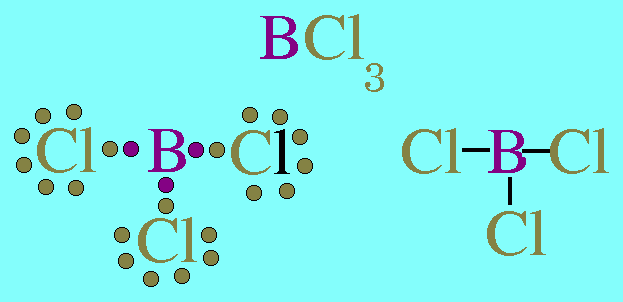
อะตอมกลาง B ในโมเลกุล BCl3มีเวเลนต์อิเล็กตรอน 3 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม Cl 3 พันธะ) พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลเป็นรูปสามเหลี่ยมแบนราบ มีมุมระหว่างพันธะเป็น 120๐ดังรูป
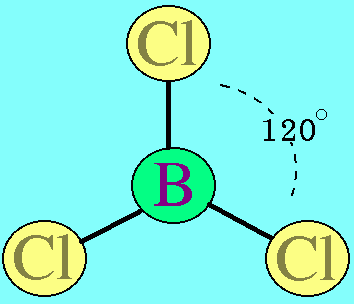
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 3 พันธะ (ไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น สามเหลี่ยมแบนราบ3. รูปร่างทรงสี่หน้าโมเลกุลมีเธน CH4มีสูตรโครงสร้างดังนี้
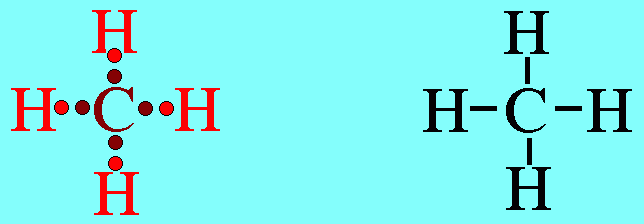
อะตอม C ในโมเลกุล CH4มีเวเลนต์อิเล็กตรอน 4 ตัว และเป็นอิเล็กตรอนคู่ร่วมพันธะทั้งหมด (สร้างพันธะเดี่ยวกับอะตอม H 4 พันธะ) เกิดการผลักกันระหว่างพันธะเพื่อให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างเป็นรูปทรงสี่หน้า มีมุมระหว่างพันธะเป็น 109.5๐ดังรูปสรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 4 พันธะ (โดยไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น ทรงสี่หน้า4. รูปร่างพีระมิดฐานสามเหลี่ยม (Trigonal bipyramkial)โมเลกุล PCl5มีสูตรโครงสร้างดังนี้
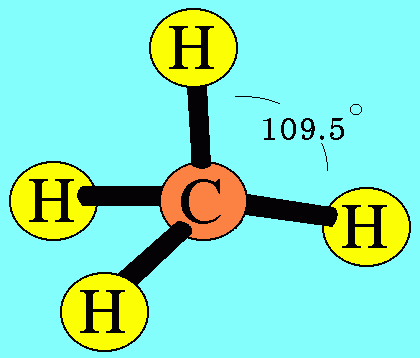
สรุปโมเลกุลโคเวเลนต์ใดๆ ถ้าอะตอมกลางมี 4 พันธะ (โดยไม่คำนึงถึงชนิดของพันธะ) และอะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว โมเลกุลจะมีรูปร่างเป็น ทรงสี่หน้า4. รูปร่างพีระมิดฐานสามเหลี่ยม (Trigonal bipyramkial)โมเลกุล PCl5 มีสูตรโครงสร้างดังนี้
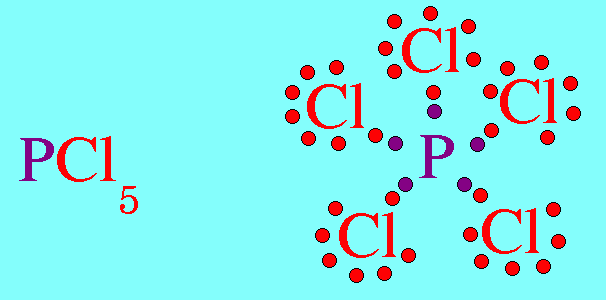
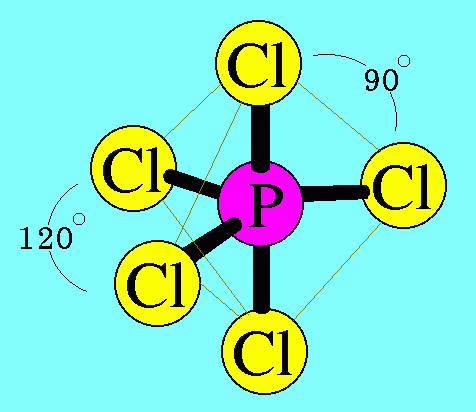
อะตอมของ P ในโมเลกุล PCl5มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ Cl ทั้ง 5 ต้ว ไม่มีอิเล็กตรอนคู่โดดเดี่ยว พันธะผลักกันให้ห่างกันมากที่สุด ทำให้โมเลกุลมีรูปร่างพีระมิดคู่
ฐานสามเหลี่ยม มีมุมระหว่างพันธะเป็น 120๐และ 90๐ดังรูป
5. ทรงแปดหน้า(Octahedral)
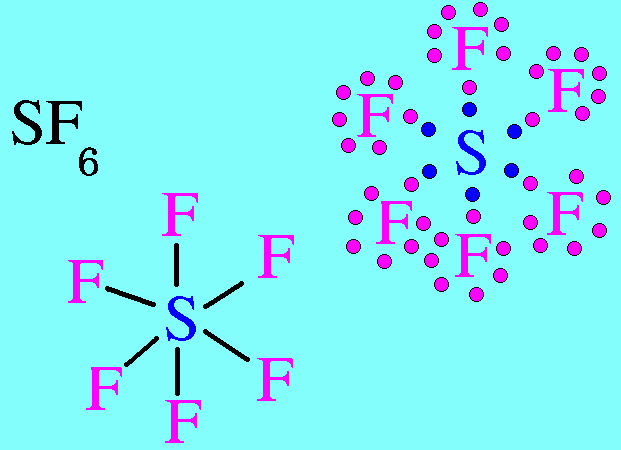
โมเลกุล SF6 มีสูตรโครงสร้างดังนี้
อะตอมของ S มีเวเลนต์อิเล็กตรอน = 6 อิเล็กตรอนทั้ง 6 ตัวสร้างพันธะเดี่ยวกับอะตอมของ F ทั้ง 6 ตัว (ไม่มีอิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนคู่ร่วมพันธะ(พันธะ) เกิดการผลักกันให้ห่างกันมากที่สุด จึงทำให้มีรูปร่างโมเลกุลเป็นรูปทรงแปดหน้า มีมุมระหว่างพันธะ 90๐ดังรูป
อิเล็กตรอนคู่โดดเดี่ยวกับรูปร่างโมเลกุล
ตามปกติอิเล็กตรอนแต่ละคู่จะออกแรงผลักกัน แรงผลักของอิเล็กตรอนแต่ละคู่จะไม่เท่ากัน ซึ่งสามารถเขียนแรงผลักระหว่างอิเล็กตรอนคู่ต่างๆ จากมากไปหาน้อยได้ดังนี้ อิเล็กตรอนคู่โดเดี่ยวกับอิเล็กตรอนคู่โดดเดี่ยว > อิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ > อิเล็กตรอนคู่ร่วมพันธะกับอิเล็กตรอนคู่ร่วมพันธะ6. รูปร่างพีระมิดฐานสามเหลี่ยมโมเลกุล NH3มีสูตรโครงสร้างดังนี้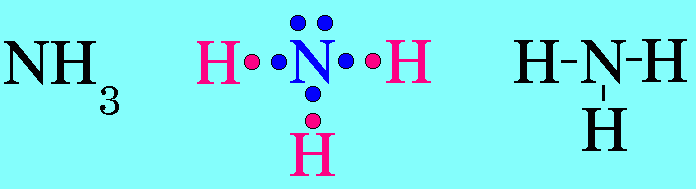
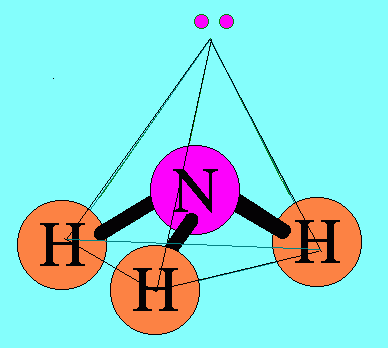
อะตอม N ในโมเลกุล NH3มีเวเลนต์อิเล็กตรอน = 5 สร้างพันธะเดี่ยวกับอะตอมของ H 3 พันธะเหลืออิเล็กตรอนไม่ได้ร่วมพันธะ 1 คู่(อิเล็กตรอนคู่โดดเดี่ยว) อิเล็กตรอนทั้ง 4 คู่รอบอะตอมกลาง ( N ) จะผลักกันให้ห่างกันมากที่สุด แต่เนื่องจากแรงผลักระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอิเล็กตรอนคู่ร่วมพันธะ มีค่ามากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะผลักกันเอง จึงทำให้มุมระหว่างพันธะ H – N ลดลงเหลือ 107๐และรูปร่างโมเลกุลเป็น รูปพีระมิดฐายสามเหลี่ยม ดังรูป
 7. รูปร่างมุมงอ
7. รูปร่างมุมงอ
โมเลกุล H2O มีสูตรโครงสร้างดังนี้
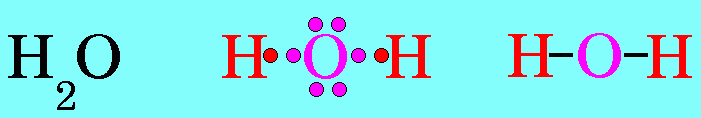
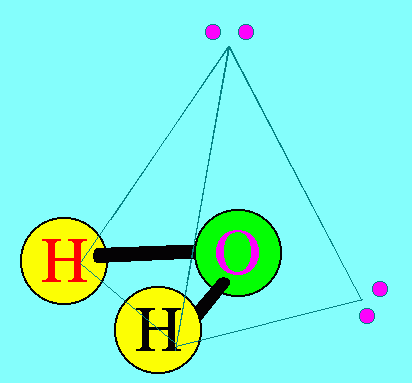
อะตอมกลาง O ในโมเลกุลของ H2O มีเวเลนต์อิเล็กตรอน = 6 สร้างพันธะเดี่ยวกับอะตอมของ H 2 พันธะ จึงมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ (4 ตัว) ซึ่งอิเล็กตรอนคู่โดดเดี่ยว 2 คู่นี้ จะมีแรงผลักอิเล็กตรอนคู่ร่วมพันธะ มากกว่าแรงผลักกันของอิเล็กตรอนคู่ร่วมพันธะ ทำให้มุมระหว่างพันธะ H – O – H มีค่าลดลงเหลือ 105๐รูปร่างโมเลกุลจึงไม่เป็นเส้นตรง แต่เป็นรูปมุมงอหรือตัววี ดังรูป
ที่มา : คลิกที่นี่
หน้าต่อไป : คลิกที่นี่


ไม่มีความคิดเห็น:
แสดงความคิดเห็น